欢迎您访问52IJ教育培训网,今天小编为你分享的化学方面的学习知识是通过网络精心收集整理的:“ksn_KSN的电子式?[化学]”,注意:所整理内容不代表本站观点,如你有补充或疑问请在正文下方的评论处发表。下面是详细内容。
是KSCN吧: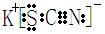
如果是KCN,则只需要把S原子的部分去除就可以.
其他类似问题
问题1:(1)C2H2 (2)CO (3)N2F2 (4)CH3NH2 (5)CH3CH3
如图.
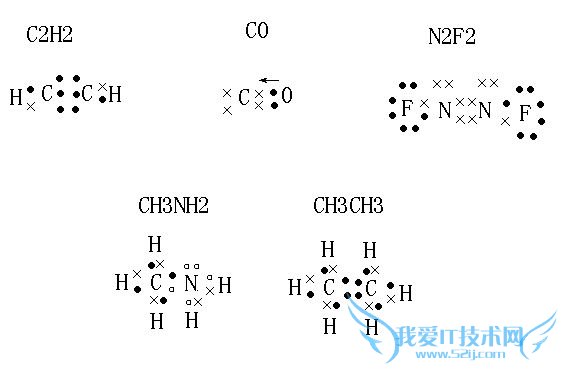
问题2:关于化学的电子式三氧化硫的电子式、老师说有配位键,[化学科目]
SO3中,S元素采取sp2杂化,在竖直方向(就是没形成杂化轨道剩下的p轨道)上的p轨道中有一对电子,在形成的杂化轨道中有一对成对电子和2个成单电子,有2个氧原子分别与其形成σ键,2个氧原子竖直方向上p轨道各有1个电子,一个氧原子与杂化轨道的孤对电子形成配位键,其竖直方向上有2个电子,这样,在4个原子的竖直方向的电子共同形成一套大π键.
配位键,又称配位共价键,是一种特殊的共价键.当共价键中共用的电子对是由其中一原子独自供应时,就称配位键.配位键形成后,就与一般共价键无异.成键的两原子间共享的两个电子不是由两原子各提供一个,而是来自一个原子.例如氨和三氟化硼可以形成配位化合物在N和B之间的一对电子来自N原子上的孤对电子.再如铵根中,N与4个H之间三个共价键一个配位键.
问题3:关于化学的电子式的为什么次氯酸的电子式,两个公用电子对都是靠近氧的.以及为什么HFO的电子H O之间是靠近O的,而O F之间是靠近F的.麻烦说的详细点.我搞不懂...[化学科目]
F的非金属性比O强,而O的非金属性比H强
周期表中右上角非金属性强,左下角金属性强
同种原子的共用电子为非极性键,即在两者正中,而不同种原子因其吸引电子能力不同而产生极性键,哪边吸引电子能力强,电子靠近哪一边
问题4:谁能告诉我化学电子式怎么写?以CO2,NaCl 为例说明下怎么写,具体的做法也说明下拜托了![化学科目]
写化学电子式,首先要明确写的物质微粒是通过什么结合的,分为二类:
离子键,这类物质写出的电子式,是由阴阳离子构成的
共价键,这类物质写出的电子式,是原子间通过共用电子对结合
NaCl是由钠离子和氯离子结合成的,对于简单阳离子电子式就是本身Na+
阴离子,因为氯原子核外7个电子,钠原子失去的电子给了氯原子,所 以得到电子保护好了,变成氯周围画满八个电子,这八个电子括号括好了,带一个单位的负电荷
CO2是由原子构成的,C最外层4个电子,还差4个电子达到稳定结构,O原子最外层6个电子,还差2个电子达到稳定结构,综上所述,一个C原子分别和两个O原子各形成两对共用电子对.
问题5:化学的电子式

- 评论列表(网友评论仅供网友表达个人看法,并不表明本站同意其观点或证实其描述)
-
