欢迎您访问52IJ教育培训网,今天小编为你分享的师说方面的学习知识是通过网络精心收集整理的:“氟化钙的溶度积_为什么氟化钙中钙离子配位数为8,氟离子的配位数为4[化学]”,注意:所整理内容不代表本站观点,如你有补充或疑问请在正文下方的评论处发表。下面是详细内容。
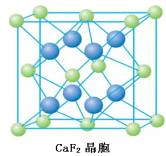
绿色为Ca,蓝色为F.如图所示,每个Ca,均位于八个F构成的立方体的体心,因而配位数为8;而每个F,均位于四个Ca构成的正四面体的体心,因而配位数为4
其他回答
CaF2
按比例呀
追问: 配位数也可以拿比例看吗?不是要看晶胞吗? 追答: 要结合晶胞结构一起看的 追问: 那么具体应该怎么看呀 追问: 那么具体应该怎么看呀 追答: 看晶体具体结构呀。然后再结合化学式,看看是否合理。其他类似问题
问题1:知道氟化钙的溶度积怎么来求钙离子和氟离子的浓度?[化学科目]
CaF2 <--> Ca2+ + 2F-
F-浓度为Ca2+浓度的2倍
所以Ksp = [Ca2+]*[F-]^2 = 4*[Ca2+]^3
[Ca2+] = 三次根号下(Ksp/4)
[F-] = 2*[Ca2+]
问题2:钙离子和氟离子比较大小还有离子大小比较规律[化学科目]
钙离子半径大.
同周期元素原子半径变化规律
在短周期(第二和第三周期)里,由左至右原子半径都是逐渐减小的,这是因为短周期中每一元素增加的最后1个电子都是排在最外电子层上,每增加1个电子,核中增加1个正电荷.正电荷增强,倾向于使原子半径缩小,但最外层电子数增加,增加了电子的互相排斥,倾向于使原子半径增大.两者互相作用的结果,核电荷增大起了主要作用,所以从左到右原子半径逐渐减小.但是,在各周期的最后一族元素(稀有气体)的原子半径比它前一族的相应元素(卤素)的原子半径大.这是因为稀有气体原子半径不是共价半径,而是范德华半径.稀有气体原子之间只以微弱的分子间作用力结合,所以原子间距离大,测出的原子半径也大.课本中的注也是说明这个意思.由于课本中还没有介绍范德华半径,只能作这样的说明.
长周期元素(第四、第五和第六周期的元素)虽然总的趋势仍然是原子半径缩小,但其中的过渡元素特别是镧系元素减小的趋势要缓和得多.这是由于过渡元素的电子填充在次外层的d轨道上,对于最外层电子(它们是决定原子大小的电子层)来说,次外层上的电子对外层的屏蔽,比最外层电子对同层上的电子的屏蔽作用大,所以过渡元素有效核电荷的增加速度变缓.但当d电子充满到nd10左右时,原子半径会突然增大.这是由于nd10有较大的屏蔽作用所致,这时电子的互相排斥倾向于使半径增大的因素暂时处于主导地位.而对镧系元素(与锕系元素均又称内过渡元素)来说,电子填充在倒数第三层4f层上,它们离核更近,对核的屏蔽作用更大,有效核电荷增加得很少,因此从58号到71号元素原子半径减少更加缓慢.
长周期的p区元素,从左至右仍然与短周期p区元素一样,维持原子半径变小的趋势,到了稀有气体,原子都有半径变大的现象.
同周期相邻元素原子半径减小的平均幅度是:
非过渡元素>过渡元素>内过渡元素
[/tr]
对于高中阶段,知道比较微粒半径时:
电子层数多,半径大
电子层数相同,原子序数大,半径小
就可以比较了.
问题3:已知溶液中氟离子钙离子和硫酸根离子浓度,如何求氟化钙和硫酸钙的溶解度[数学科目]
这道题求的是氟化钙和硫酸钙的浓度吧
设硫酸根离子浓度为x,那么CaSO4的浓度也为x,因为已知钙离子浓度(暂设为y)所以CaCl2电离出的钙离子浓度就为y-x,则氯离子浓度为2(y-x),将已知数代入方程,则求出钙离子浓度,从而知道氟化钙和硫酸钙的浓度.
望采纳,谢谢!
问题4:锂离子、氧离子、氟离子、钠离子、镁离子、铝离子、硫离子、氯离子、钾离子、钙离子符号及电子排布示意图[化学科目]
锂离子Li2+:2
氧离子O2-:2 8
钠离子Na+:2 8
镁离子Mg2+:2 8
铝离子Al3+:2 8
硫离子S2-:2 8 8
氯离子Cl-:2 8 8
钾离子K+:2 8 8
钙离子Ca2+:2 8 8
问题5:为什么氟化钙的钙离子浓度比碳酸钙高从溶度积方面考虑[化学科目]
从相对原子质量的角度来看:氯原子(离子)的相对原子质量是35.5,而碳酸根离子的相对原子(团)质量是96.因此CaCl2中Ca%=36.04%,CaCO3中Ca%=29.41%.因此氟化钙的钙离子浓度比碳酸钙高.至于溶液浓度54.
- 评论列表(网友评论仅供网友表达个人看法,并不表明本站同意其观点或证实其描述)
-
